2018届高三年级第二次模拟考试(九)
发布时间:2018/10/17 8:11:06 作者:马明祥 浏览量:1645次
2018届高三年级第二次模拟考试(九)
南京盐城二模化 学
本试卷分选择题和非选择题两部分,共120分,考试用时100分钟。
可能用到的相对原子质量:H 1 C 12 O 16 S 32 Cl 35.5 Cu 64 I 27
选择题(共40分)
单项选择题:本题包括10小题,每小题2分,共计20分。每小题只有一个选项符合题意。
1. 十九大报告提出“坚持人与自然和谐共生”。下列做法不符合此理念的是( )
A. 生活垃圾分类收集处理 B. 选用无磷洗涤剂洗涤衣物
C. 使用布袋代替一次性塑料袋购物 D. 家庭日常用餐使用一次性筷子
2. 下列有关化学用语表示正确的是( )
A. 中子数为20的氯原子:Cl B. Cl-的结构示意图:![]()
C. NCl3的电子式:![]() D. 聚氯乙烯的结构简式:
D. 聚氯乙烯的结构简式: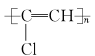
3. 下列有关物质的性质与用途不具有对应关系的是( )
A. 二氧化硫有还原性,可用于漂白纸浆
B. KI具有还原性,可制成淀粉KI试纸检验氧化性物质的存在
C. 锌的金属活动性比铁强,可在海轮外壳上镶上一定数量的锌块以防止船体腐蚀
D. 硅的导电性介于导体和绝缘体之间,可用于制造计算机硅芯片的材料
4. 下列有关实验装置正确且能达到实验目的的是( )
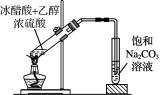
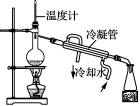
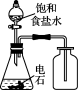
![]()
图1 图2 图3 图4
A. 用图l装置制取少量乙酸乙酯 B. 用图2装置制少量蒸馏水
C. 用图3装置制取并收集乙炔气体 D. 用图4装置分离苯和苯酚
5. 短周期主族元素X、Y、Z、W的原子序数依次增大,X原子核外最外层电子数是次外层的2倍,Y元素无正化合价,Z元素最高价氧化物对应的水化物是一种强碱,W的最高正价为+6价。下列说法正确的是( )
A. 原子半径:r(W)>r(Z)>r(Y)
B. 最高价氧化物对应水化物的酸性:W>X
C. 简单气态氢化物的热稳定性:W>Y
D. W分别与X、Z形成的化合物中所含化学键类型相同
6. 下列离子方程式书写正确的是( )
A. Na2CO3溶液中CO的水解:CO+2H2O![]() H2CO3+2OH-
H2CO3+2OH-
B. 用稀硝酸洗涤试管内壁银镜:Ag+4H++NO===Ag++NO↑+2H2O
C. 向澄清石灰水中通入氯气:Cl2+Ca(OH)2===Ca2++Cl-+ClO-+H2O
D. NaHSO4溶液与Ba(OH)2溶液反应至中性:2H++SO+Ba2++2OH-===BaSO4↓+2H2O
7. 给定条件下,下列选项中所示的物质间转化不能一步实现的是( )
A. NaCl(aq)Cl2NaClOHClO
B. SSO2SO3H2SO4
C. NaAlO2(aq)Al(OH)3AlCl3(aq)Al
D. FeFeCl2(aq)Fe(OH)2Fe(OH)3
8. 下列说法正确的是( )
A. 分子式为C2H4O2的有机物不一定有酸性
B. 利用复分解反应可实现FeSO4向FeO(OH)的转化
C. 相同质量的红磷分别在空气中和纯氧中完全燃烧,后者放出的热量多
D. 选用适当的催化剂,可以改变可逆反应反应物的平衡转化率
9. 常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A. 加入铝粉能放出氢气的溶液中:Na+、Mg2+、Cl-、NO
B. 由水电离出的c(OH-)=1.0×10-13 mol·L-1的溶液中:Fe2+、NH、ClO-、SO
C. 0.1 mol·L-1的NH4HCO3的溶液中:K+、Na+、CO、Br-
 D. 0.1 mol·L-1的FeCl3的溶液中:K+、Cu2+、SCN-、I-
D. 0.1 mol·L-1的FeCl3的溶液中:K+、Cu2+、SCN-、I-
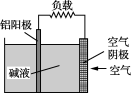
10. 铝—空气燃料电池是一种机械式可“充电”电池(结构简图见右)。铝阳极是在高纯铝中添加合金元素制成,合金元素的加入可降低阳极自溶腐蚀速度;空气阴极主要由催化剂和透气膜组成,催化剂可将电极反应生成的HO催化分解为O2和OH-。下列关于该电池的说法错误的是( )
A. 铝阳极的电极反应式是:Al-3e-===Al3+
B. 空气电极的电极反应式是:O2+H2O+2e-===OH-+HO
C. 阳极自溶腐蚀反应为:2Al+2NaOH+2H2O===2NaAlO2+3H2↑
D. 该电池再“充电”可直接更换铝阳极并补充适量碱液
不定项选择题:本题包括5小题,每小题4分,共计20分。每小题只有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题得0分;若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得满分,但只要选错一个,该小题就得0分。
11. 化合物a和b都是合成抗肝病药莳萝脑的中间体,其相互转化关系如下,下列说法不正确的是( )
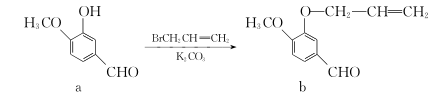
A. 可用FeCl3溶液鉴别a和b
B. a、b均能与新制的Cu(OH)2在加热煮沸条件下反应产生砖红色沉淀
C. a和b分子中所有原子均处于同一平面上
D. a、b分子中均无手性碳原子
12. 下列说法正确的是( )
A. 铅蓄电池放电时的负极和充电时的阳极均发生还原反应
B. 0.1 mol·L-1氨水溶液加水稀释后,溶液中的值减小
C. 标准状况下,11.2 L N2和O2的混合气体中分子数为6.02×1023
D. 反应Ba(OH)2(aq)+H2SO4(aq)===BaSO4(s)+2H2O(l)的ΔH<0,ΔS>0
13. 根据下列实验操作和现象所得到的结论正确的是( )
选项 | 实验操作和现象 | 实验结论 |
A | 将含有SO2的废气通入BaCl2溶液中,出现白色沉淀 | SO2与BaCl2溶液反应生成BaSO3沉淀 |
B | 向某密闭容器充入NO2,保持温度不变,慢慢扩大容器体积,最终容器中气体颜色比开始时浅 | 平衡2NO2(g) |
C | 向蔗糖中加入适量浓硫酸,并不断用玻璃棒搅拌,蔗糖变黑,体积膨胀,并放出刺激性气味气体 | 浓硫酸具有脱水性和强氧化性 |
D | 在酒精灯上加热铝箔,铝箔熔化,熔化的铝并不滴落 | 熔点:氧化铝>铝 |
14. 25℃时,下列有关溶液中微粒的物质的量浓度关系正确的是( )
A. 0.1 mol·L-1(NH4)2Fe(SO4)2溶液中:
c(SO)>c(NH)>c(Fe2+)>c(H+)>c(OH-)
B. pH=9的NaHCO3溶液中:c(OH-)=c(H2CO3)+c(H+)+c(HCO)
C. 向0.1 mol·L-1 CH3COONa溶液中通入HCl至溶液pH=7:
c(Na+)>c(Cl-)=c(CH3COOH)>c(H+)
D. pH=11的氨水和pH=3的盐酸等体积混合,所得溶液中:
c(Cl-)>c(NH)>c(OH-)>c(H+)
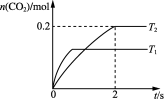 15. 汽车尾气净化的主要反应原理为2NO(g)+2CO(g)2CO2(g)+N2(g)。将1.0 mol NO、0.5 mol CO充入2 L恒容密闭容器,分别在T1℃和T2℃下测得n(CO2)随时间(t)的变化曲线如图所示。下列说法正确的是( )
15. 汽车尾气净化的主要反应原理为2NO(g)+2CO(g)2CO2(g)+N2(g)。将1.0 mol NO、0.5 mol CO充入2 L恒容密闭容器,分别在T1℃和T2℃下测得n(CO2)随时间(t)的变化曲线如图所示。下列说法正确的是( )
A. 该反应的ΔH>0
B. T2℃,0~2 s内的平均反应速率v(N2)=0.025 mol·L-1·s-1
C. T2℃,2 s时再向容器中充入CO、N2各0.3 mol,平衡不发生移动
D. T1℃,若将反应的容器改为绝热容器,则反应达平衡时,NO平衡浓度比恒温容器中小
非选择题(共80分)
16. (12分)聚合硫酸铁铝、聚合氯化铝是高效水处理剂。以废铁屑、废铝质易拉罐及硫酸为原料,制备聚合硫酸铁铝的工艺流程如下:
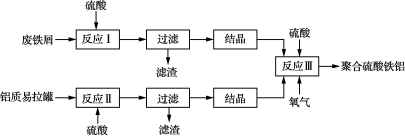
(1) 为提高反应Ⅰ、Ⅱ金属元素的浸出率,可以采取的措施有______________________。
(2) 反应Ⅲ中FeSO4转化为Fe2(SO4)3的化学方程式为____________________________。
(3) 反应Ⅲ的温度应控制在50℃~70℃为宜,原因是_______________________________
_________________________________________________________________。反应Ⅲ过程中往往加入少量硝酸铝,其作用如图1所示,转化①的离子方程式为______________________。
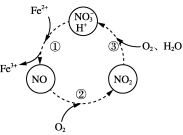
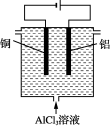
图1 图2
(4) 写出Fe2(SO4)3水解生成![]() 的离子方程式:_________________。
的离子方程式:_________________。
(5) 利用图2所示电解装置可制备净水剂聚合氯化铝。实际生产中,阳极附近因为副反应可能产生的气体有________。
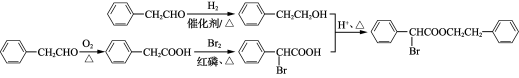
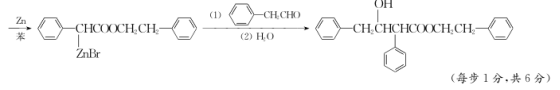
17. (15分)化合物Ⅰ是一种医疗用的扩瞳剂,其合成路线如下:
 (1) E中的官能团名称为________、________。
(1) E中的官能团名称为________、________。
(2) D→E的反应类型为________。
(3) 写出同时满足下列条件的F的一种同分异构体的结构简式:________________________________________________________________________。
①含有苯环,能发生银镜反应;②酸性条件下水解的产物之一与FeCl3溶液能发生
显色反应;③分子中有4种不同化学环境的氢。
(4) H的分子式为C15H20O3,写出H的结构简式:________________________________________________________________________。
(5) 请写出以![]() 为原料制备
为原料制备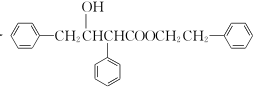 的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)。
的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)。
18. (12分)黄铜是由铜和锌所组成的合金(含铜约80~90%),测定某黄铜中铜的质量分数的步骤如下:
①准确称取0.150 0 g黄铜试样置于锥形瓶中,加入适量的H2SO4和H2O2的混合液,加热使试样完全溶解后,再加热煮沸1~2 min,冷却。
②向步骤①所得溶液中加入10.00 mL 20%的KI溶液(足量),充分反应后用0.100 0 mol·L-1 Na2S2O3溶液滴定至浅黄色(反应的离子方程式为I2+2S2O===2I-+S4O)。
再加入3.000 mL 0.5%的淀粉指示剂,继续滴定至浅蓝色,加入10.00 mL 10%的NH4SCN溶液,继续滴定至溶液浅蓝色消失。
已知:(Ⅰ) 2Cu2++4I-===2CuI↓+I2
(Ⅱ) Ksp(CuI)=1.2×10-12;Ksp(CuSCN)=4.8×10-15
(1) H2SO4和H2O2的混合液溶解Cu的化学方程式为________________________________________________________________________。
(2) 步骤①试样完全溶解后再加热煮沸1~2 min的目的是________________________________________________________________________。
(3) 步骤②中加入的NH4SCN可使CuI转化为CuSCN:CuI(s)+SCN-![]() CuSCN(s)+I-,该反应的平衡常数为________。
CuSCN(s)+I-,该反应的平衡常数为________。
(4) 实验中共消耗Na2S2O3溶液20.00 mL,计算该黄铜样品中铜的质量分数(写出计算过程)。
19. (15分)实验室用CuO制备超细Cu粉流程如下:

已知:①Cu(OH)2+4NH3·H2O===[Cu(NH3)4]2++2OH-+4H2O
②Cu+在酸性条件下歧化为Cu2+和Cu。
(1) “酸溶”时,控制硫酸稍过量且又不过量太多的原因是_________________________。
(2) 反应Ⅰ加入过量氨水的操作为_________________________________________。
(3) 写出反应Ⅱ的化学方程式:__________________________________________。
(4) 从滤液中获得副产品硫酸铵晶体的实验方法为________________________(已知硫酸铵在280 ℃时分解,0 ℃时溶解度为70.1 g,100 ℃时溶解度为102 g)。
(5) “洗涤”的操作为_______________________________________________________。
(6) 请设计从CuNH4SO3制取超细粉末Cu的实验方案:________________________________________(实验中须使用的试剂有:1 mol·L-1 H2SO4溶液)。
20. (14分)氨氮是水体中氮的主要形态之一,氨氮含量过高对水中生物会构成安全威胁。
(1) 一定条件下,水中的氨氮可以转化为氮气而除去。
已知:2NH(aq)+3O2(g)===2NO(aq)+2H2O(l)+4H+(aq) ΔH=a kJ·mol-1
2NO(aq)+O2(g)===2NO(aq) ΔH=b kJ·mol-1
5NH(aq)+3NO(aq)===4N2(g)+9H2O(l)+2H+(aq) ΔH=c kJ·mol-1
则4NH(aq)+3O2(g)===2N2(g)+6H2O(l)+4H+(aq) ΔH=________kJ·mol-1
(2) 实验室用电解法模拟处理氨氮废水。电解时,不同氯离子浓度对溶液中剩余氨氮浓度的影响如图所示。增大氯离子浓度可使氨氮去除率________(填“增大”“减小”或“不变”),其主要原因可能是_________________________________________________________。

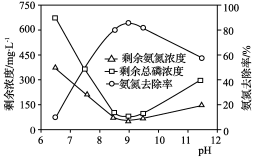
图1 图2
(3) 化学沉淀法是一种处理高浓度氨氮废水的有效方法。通过加入MgCl2和Na2HPO4将NH转化为MgNH4PO4·6H20沉淀(Ksp=2.5×10-13)去除。25℃时,在氨氮初始质量浓度400 mg·L-1,n(Mg)∶n(P):∶n(N)=1∶1∶1的条件下,溶液pH对氨氮去除率及剩余氨氮浓度和总磷浓度的影响如图2所示。
①反应生成MgNH4PO4·6H2O的离子方程式为__________________________________。
②该实验条件下,控制溶液的适宜pH范围为________;当pH范围在9~11时,溶液中总磷浓度随pH增大而增大的主要原因是(用离子方程式表示)________________________________________________________________________。
21. (12分)【选做题】本题包括A、B两小题。请选定其中一个小题,并作答。若多做,则按A小题评分。
A. [物质结构与性质]
甘氨酸锌是一种新型食品营养强化剂,可由ZnO与甘氨酸(![]() )制备。
)制备。
(1) Zn2+基态核外电子排布式为____________________。
(2) 甘氨酸分子中碳原子轨道的杂化类型是________,1 mol 甘氨酸分子中含有σ键的数目为________。
(3) 以氧化锌矿物为原料,提取锌的有关反应为:ZnO+2NH3+2NH===[Zn(NH3)4]2++H2O。与NH互为等电子体的阴离子为________,[Zn(NH3)4]2+的结构可用示意图表示为________________________。
(4) 闪锌矿的主要成分是一种锌的硫化物,其晶胞结构如图所示,其化学式为________。
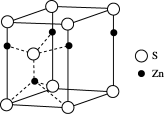
B. [ 实验化学]
实验室由环己烯一步氧化制备1,2环己二醇:
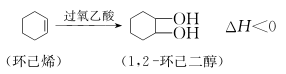
(已知:1,2环己二醇可溶于水,熔点73~77℃,沸点118~120℃)
实验步骤如下:

步骤1:向右图所示装置三颈烧瓶中加入60 mL乙酸,再加入几滴硫酸,随即加入15 mL 30%的双氧水,低速搅拌1.5小时。
步骤2:控制反应温度40~45℃,不断搅拌下由恒压漏斗向三颈烧瓶中缓慢滴加11 mL环己烯,冷凝回流45 min。
步骤3:将步骤2反应后的产物进行减压精馏后,加入35%的NaOH溶液,充分反应后,移入分液漏斗中,并加入乙酸丁酯振荡、分液。
步骤4:将步骤3中的有机层减压蒸馏回收溶剂,过滤,得到1,2—环己二醇。
请回答下列问题:
(1) 装置中冷凝水从________(填“a”或“b”)端进。
(2) 步骤2中加入环己烯要缓慢的原因是_______________________________________。
(3) 步骤2控制反应温度为40~45℃的常用方法是_____________________________。
(4) 步骤3中加入35%的NaOH溶液主要是对步骤2中的产物进行水解反应,其原因是
________________________________________________________________________。
(5) 步骤3中水解反应完成的现象是___________________________________________。
(6) 步骤3加入乙酸丁酯振荡、分液的目的是_____________________________________。
2018届南京、盐城高三年级第二次模拟考试(九)
化学参考答案
1. D 2. C 3. A 4. B 5. B 6. D 7. C 8. A 9. C 10. A
11. C 12. B 13. CD 14. AC 15. BC
16. (12分)
(1) 适当提高硫酸浓度:适当提高反应温度等(2分)
(2) 4FeSO4+O2+2H2SO4===2Fe2(SO4)3+2H2O(2分)
(3) 温度过低,反应速率太慢;温度过高,金属离子水解趋势增强,易形成沉淀,影响产品的质量(2分)
3Fe2++4H++NO===3Fe3++NO↑+2H2O(2分)
(4) 2Fe3++SO+nH2O![]() Fe2(OH)n(SO4)3-+bH+(2分)
Fe2(OH)n(SO4)3-+bH+(2分)
(5) Cl2、O2(2分)
17. (15分)
(1) 溴原子 羧基(各1分,共2分)
(2) 取代反应(1分)
(3)  (4)
(4) ![]() (3分)
(3分)
(5) 
 18. (12分)
18. (12分)
(1) Cu+H2O2+H2SO4===CuSO4+2H2O(2分)
(2) 除去溶液中过量的H2O2(2分)
(3) 250(2分)
(4) 解:2Cu2+ ~ I2~2Na2S2O3
n(Na2S2O3)=20.00 mL×10-3 L/mL×0.1 000 mol·L-1=2.000×10-3 mol(1分)
n(I2)=n(Na2S2O3)=×2.000×10-3 mol=1.000×10-3 mol(1分)
n(Cu)=n(Cu2+)-2n(I2)=2.000×10-3 mol(1分)
m(Cu)=n(Cu)×64 g·mol-1=2.000×10-3 mol×64 g·mol-1=0.128 g(1分)
ω(Cu)=×100%=85.3%(2分)
答:该黄铜样品中含铜质量分数为85.3%
19. (15分)
(1) 过量的H2SO4能使CuO充分溶解(反应),但H2SO4过量太多会增加反应Ⅰ中氨水的用量(2分)
(2) 向反应器中滴加氨水产生蓝色沉淀,继续边振荡边滴加至沉淀恰好消失(2分)
(3) 2Cu(NH3)4SO4+3SO2+4H2O===2CuNH4SO3↓+3(NH4)2SO4(2分)
(4) 蒸发结晶(浓缩结晶)、过滤、洗涤(2分)
(5) 向过滤器中注入蒸馏水全浸没沉淀,让水自然流出,重复操作2~3次(2分)
(6) 向CuNH4SO3(白色固体)中滴加1 mol·L-1 H2SO4溶液,搅拌使其充分反应,待无气泡产生(或白色固体完全转变为少量的红色固体),停止滴加溶液,静置,过滤,洗涤,干燥(5分)
20. (14分)(方程式3分,其余每空2分)
(1) (3a+3b+2c)
(2) 增大 阳极生成的Cl2能够将NH氧化为氮气(或NO)而除去
(3) ①HPO+Mg2++NH+6H2O===MgNH4PO4·6H2O↓+H+
②8.5~9.5 MgNH4PO4+2OH-===Mg(OH)2+NH+PO
或MgNH4PO4+3OH-===Mg(OH)2+NH3·H2O+PO
21. (12分)【选做题】
A. [物质结构与性质]
(1) 1s22s22p63s23p63d10或[Ar]3d10(2分)
(2) sp2、sp3(2分) 9 mol(2分)
(3) BH(2分) ![]() (2分)
(2分)
(4) ZnS(2分)
B. [实验化学]
(1) b(2分)
(2) 反应放热,滴加速度过快,体系温度迅速上升导致过度氧化(2分)
(3) 水浴加热(2分)
(4) 使步骤2中生成的1,2—环己二醇与乙酸发生副反应生成的酯水解,提高1,2—环己二醇的产率(2分)
(5) 容器中分层消失(2分)
(6) 萃取产品中的1,2—环己二醇(2分)
| A | B |
南京 | 90 | 74 |
盐城 | 90 | 79 |
连云港 | 89 | 71 |
![]()





